
Заманауи цифрлы білім беру ортасын ұсынамыз
Oqulyqtar платформасы – бұл сілтемелік технологияға негізделген білім беру ортасы
- әлемдегі ең озық білім беру жүйесінде қолданылады, мысалы, Эстония, Финляндияда;
- мемлекеттік оқу бағдарламасына сәйкес келетін, қатары үнемі көбейіп отыратын жоғары сапалы электронды оқулықтардан тұрады;
- негізгі қолданушылар – мектеп, мұғалім, оқушы, ата-ана, жеке қолданушы.
Қазақстандағы жетекші баспалардың 220-дан астам электронды оқулықтары
Oqulyqtar платформасының кітапханасында баспа, мектеп және отбасын байланыстыратын барлық сынып пәндерінің цифрлы оқулықтары бар. Қазір порталда «Атамұра», «Мектеп» және «Көкжиек-Горизонт» баспаларының оқулықтары орналастырылған. Оқулықтар қатары көбейіп отырады.
Кітапханаға кіріңіз немесе пән атауы бойынша қажетті оқулықты табыңыз:
Баспагерлерге арналған Oqulyqtar
Қосымша ақпарат алу үшін info@oqulyqtar.kz электронды поштасына жазыңыз.
Әрбір қолданушы үшін ұсынылатын артықшылықтар!
Oqulyqtar – ауқымды функционалды және оқу материалдары бар білім беру ортасы.

Мектеп
Оқушылар мен мұғалімдерді оқу материалдарымен қамтамасыз ететін заманауи мектеп үшін.
Толығырақ
Мұғалім
Сіз үшін мектеп оқушысының көңілінен шығатындай қызықты, танымдық әрі есте қаларлық сабақтар!
Толығырақ
Оқушы
Оқулықтар, тапсырмалар мен меңгерген білім нәтижелері – барлығы бір жерде! Кез келген орында, кез келген сәтте материалдарға тез әрі оңай қол жеткізу.
ТолығырақПакеттер мен бағалар
Атамұра

Мектеп

Көкжиек-Горизонт

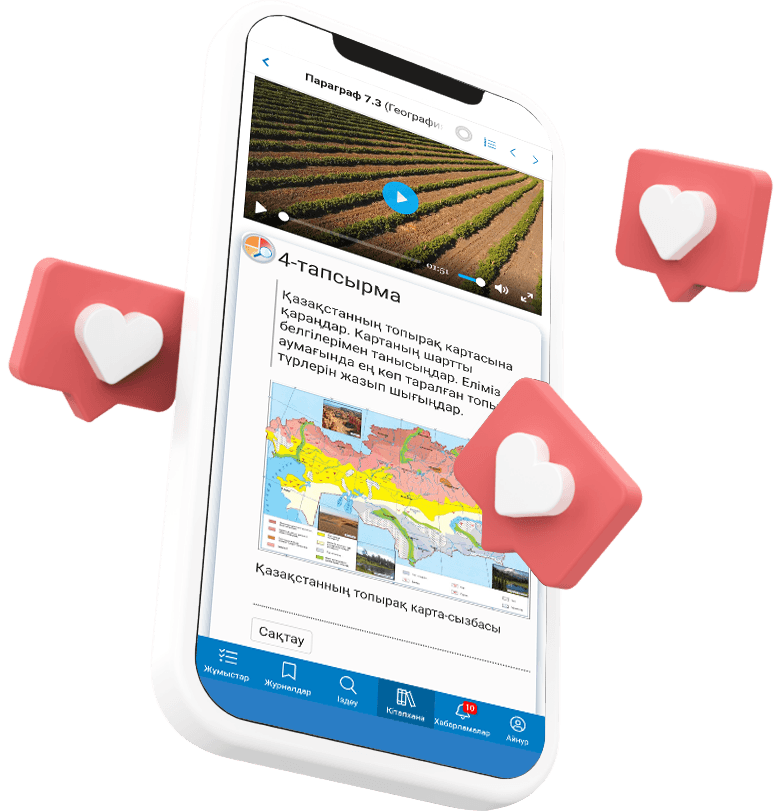
Oqulyqtar қосымшасын жүктеу
Oqulyqtar платформасын кез келген интернет-браузер арқылы пайдалануға болады, сондай-ақ смартфон мен планшеттерге арналған қосымша да бар. Oqulyqtar платформасындағы барлық мүмкіндіктерді пайдаланып, материалдарды тез тауып, хабардар бола аласыз.
Назар аударуыңызды сұраймыз!
- Oqulyqtar қосымшасындағы есептік жазбаңызға кіру үшін сізде Oqulyqtar платформасының жарамды есептік жазбасы болуы керек.
- Oqulyqtar қосымшасындағы ақылы материалдарға қол жеткізу үшін лицензия сатып алу қажет.

Oqulyqtar – сенімді платформа!
-
Мазмұны оқу бағдарламаларына сәйкес
Opiq платформасында орналасқан барлық цифрлы оқулықтар оқу бағдарламаларына сәйкес жасалған. Республикалық ғылыми-практикалық білім беру мазмұнын сараптау орталығының сараптамасынан өткен. Қазақстан Республикасының Оқу-ағарту министрлігі ұсынған.
-
Оқу материалын табу және ашып жұмыс істеу
Opiq-те қосымша оқу материалын табуға арналған негізгі мәтіннің астында материалды қосу және біріктірілген мазмұнды қосу түймешесі бар. Қолданушы әртүрлі іздеу батырмасын таңдай алады. Жасанда интеллект бір пәнде бұрын өткен және кейін өтетін материалды іздеп табуға мүмкіндік береді.
-
Қауіпсіздік талаптары
Opiq цифрлы оқулықтарды заманауи технологияларды қолдана отырып жасаған. Халықаралық стандарттарға сәйкес барлық қауіпсіздік талаптары сақталған. Opiq платформасын орналасқан барлық материалдар кез келген қолданушы үшін қолжетімді.
-
Барлық құрылғыда жұмыс істеуі
Операциялық жүйесіне немесе құрылғының моделіне қарамастан кез келген смартфонда, планшетте, ноутбукте, дербес компьютерде жұмыс істейді.





